神経変性疾患研究
筋萎縮性側索硬化症の分子病態研究
筋萎縮性側索硬化症(ALS)は上位運動ニューロンと下位運動ニューロンが選択的かつ進行性に変性・消失していく神経変性疾患です.病勢の進展は比較的速く,人工呼吸器を用いなければ通常は2~5年で死亡します.当研究室は,この難治性疾患であるALSを克服すべく,その分子病態の解明と,治療法の開発を目指し,研究を行っています.
1869年にシャルコーにより報告されたALSは,長らく,その病態が明らかとなっていなかった運動ニューロン疾患でした.しかし,2006年,ALS患者の残存運動ニューロンにおける封入体の主要構成成分が,RNA結合タンパク質であるTDP-43であることが明らかとなり,病態研究が飛躍的に進展する契機となりました.さらに2008年には,TDP-43の突然変異が,家族性ALSの原因遺伝子の一つであることが,当研究室からの報告を含め,明らかとなりました (Yokoseki et al, 2008).現在は35以上のTDP-43遺伝子変異が知られています.世界に先駆けた我々の研究成果は,ALSの発症にTDP-43が直接的に関与することを示し,その後のALS研究の方向性に大きな影響を与えました.
この頃より,ALSの新規原因遺伝子が相次いで報告されました.これらにはTDP-43と同様にRNA代謝に関わるRNA結合タンパク質(FUS,HNRNPA1,TIA1など)や,タンパク質品質保持に関わる遺伝子(OPTN,VCP,UBQLN2など)が含まれます.欧米ではC9orf72 遺伝子変異が最も多い原因であることが報告されましたが,当研究室では,家族性A LSのなかからC9orf72遺伝子変異例を見出し,本邦では稀な遺伝子変異であることを報告しました(Konno et al, 2012).重要なことは,これらの遺伝性変異の大部分と,孤発性ALSのほぼすべての症例において,正常では主に核内に存在するTDP-43が,核から消失し,細胞質で凝集体を形成して蓄積していることです.したがって,TDP-43の機能喪失と,凝集体形成に伴う毒性が,ALS病態に深く関与しているものと考えられます.
TDP-43はRNA結合タンパク質として,さまざまなRNA代謝に関わっていますが,なかでもRNAスプライシングの制御が重要です.当研究室では,スプライシング反応をつかさどる高分子複合体であるスプライソソームの形成に関与するGEM小体が,ALS運動ニューロンで減少していることを報告しました(Ishihara et al, 2013).TDP-43の発現量はGEM小体の数に影響し,GEM小体の発現低下は,機能性RNAの一種であるU small nuclear RNAの発現低下を来たし,正常なmRNAのスプライシングを阻害します(図1).
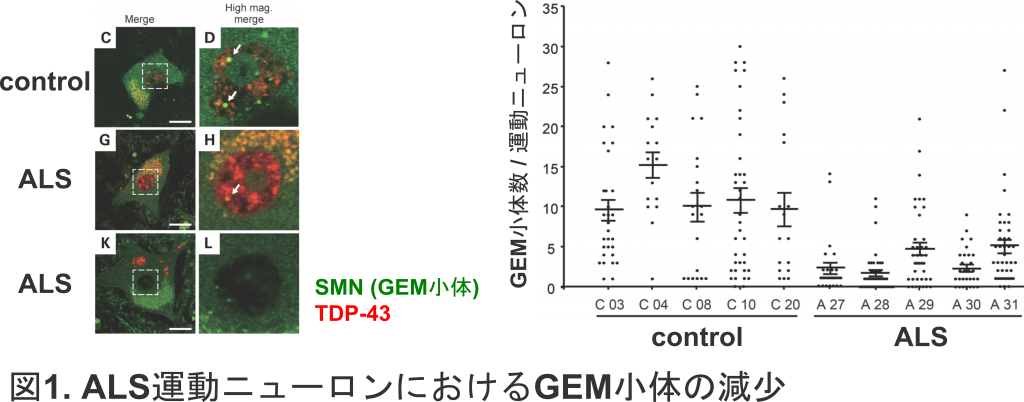
RNAスプライシングに関わるもうひとつの機構は,TDP-43が直接的にターゲットRNAに結合し,そのスプライシングを制御することです.当研究室では,このターゲットRNAのひとつに細胞の大きさに関連する遺伝子であるPOLDIP3の選択的スプライシングがあり,ALS運動ニューロンにおいては,このスプライシングの乱れが生じていることを見出しました(Shiga et al, 2012).
一方,TDP-43の発現量に応じて,最も鋭敏に制御されているスプライシングのひとつは,TDP-43自身をコードするRNAになります.TDP-43タンパク質は,TDP-43 RNAの3’非翻訳領域(3’UTR)に核内で結合し,選択的ポリA部位を変化させ,二つのイントロンの選択的スプライシングを誘導します.このようなスプライシングをうけたメッセンジャーRNA(mRNA)は,ナンセンス変異依存mRNA分解機構(NMD)を介して分解されます(Koyama et al, 2016).このことは,核内TDP-43発現量に応じて自身をコードするRNA量を制御するという,自己調節が行われていることを意味します(図2).
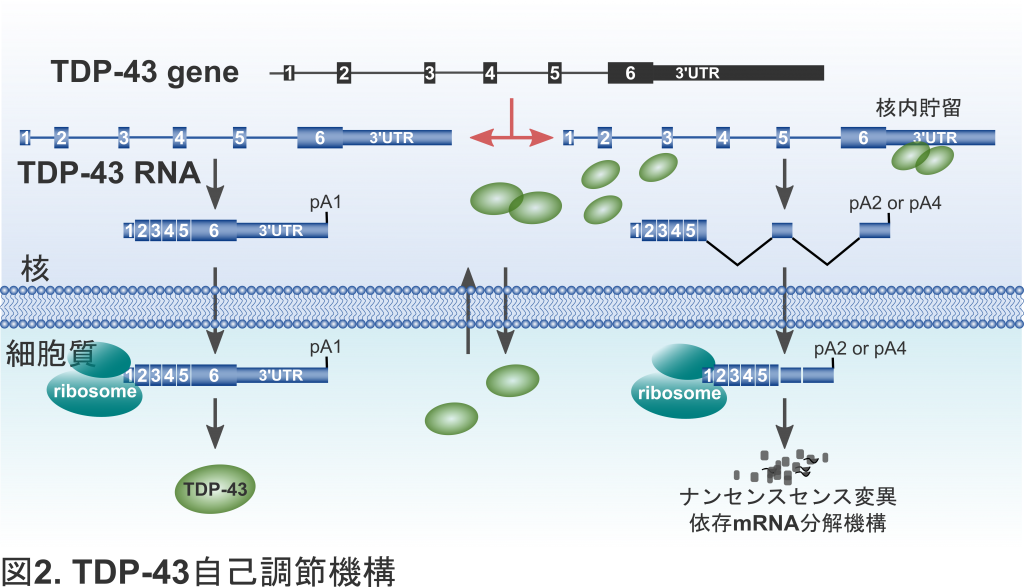
TDP-43が減少すると,この自己調節機構により,TDP-43 RNAの二つの選択的スプライシングが減少し,TDP-43をコードするmRNAが増加します.実際,当研究室では,核内TDP-43が減少するALSでは,このスプライシングが減少し,その運動ニューロンでは,細胞質においてTDP-43が蓄積しているにも関わらず,TDP-43をコードするmRNAが増加していることを見出しました(Koyama et al, 2016)(図3).
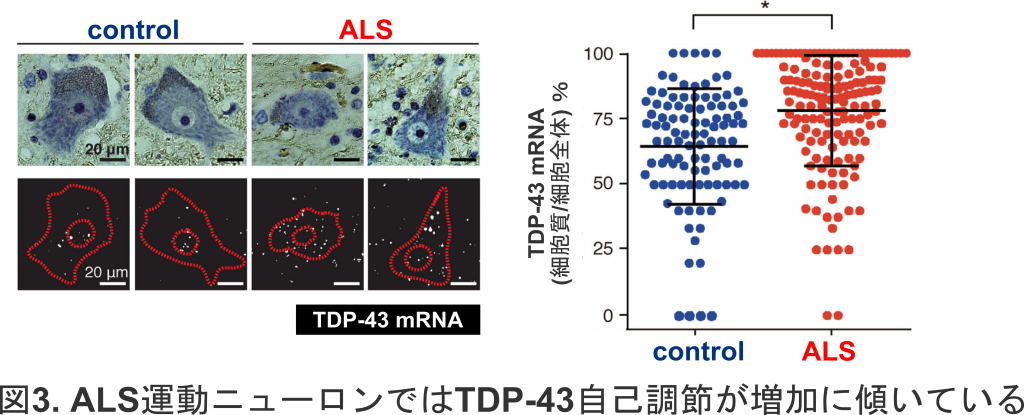
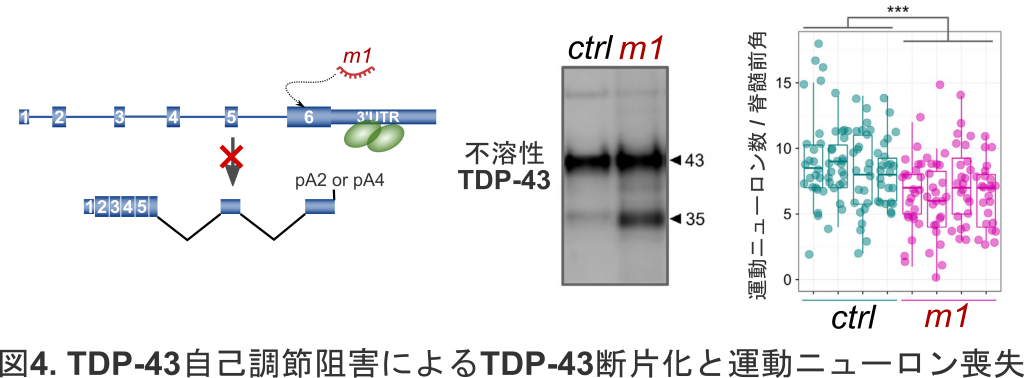
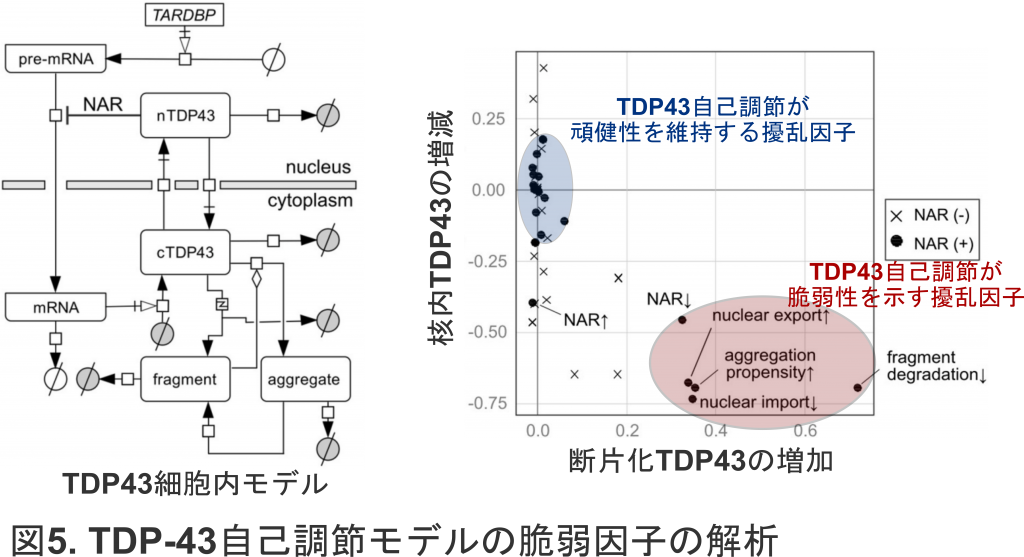
さらに我々は,TDP-43 RNAの選択的スプライシングを特異的に減少させ,TDP-43をコードするmRNAが増加する病態モデルを構築しました.マウスの髓腔内に選択的スプライシングを特異的に阻害するアンチセンス核酸を導入すると,脊髄組織において,ALSで認められるような不溶性・断片化TDP-43が増加し,運動ニューロンの喪失が起きることを見出しました(図4).このことは,TDP-43の自己調節の破綻がALS病態を導き得ること,また,核内TDP-43の減少が続くと,凝集のもととなるTDP-43の発現が増加し続け,悪循環の病態に陥ることを示唆します(Sugai et al, 2019).すなわち,本来は,発現量をロバストに自己調節しているTDP-43ですが,ひとたび病気のフェーズに突入すると,この自己調節機構が,ALSの病態を促進してしまうといえます.
そこで,細胞内のTDP-43動態をコンピュータ上でモデル化して解析しました.TDP-43自己調節は,細胞内で起こり得るさまざまな擾乱に対し,TDP-43の発現の量を一定に維持しましたが,いくつかの特殊な擾乱に対しては,この頑健性は崩れ,逆に脆弱性が顕わになることが分かりました(図5).これらの擾乱に対する脆弱性は,一般的な細胞内の擾乱に対する頑健性を強めれば強めるほど顕著になってくるという,トレードオフの関係がみられました (Sugai et al, 2018).したがって,TDP-43のロバストネスを崩すこれらの擾乱因子の制御は,ALSの治療ターゲットになり得るものと考えられます.
以上のような知見の積み重ねをもとに,当研究室では,これをさらに発展させ,ALSに対する革新的な治療法の開発に取り組んでいます.
参考文献
- Yokoseki A, Shiga A, Tan C-F, Tagawa A, Kaneko H, Koyama A, Eguchi H, Tsujino A, Ikeuchi T, Kakita A, Okamoto K, Nishizawa M, Takahashi H & Onodera O (2008) TDP-43 mutation in familial amyotrophic lateral sclerosis. Ann. Neurol. 63: 538-42
- Konno T, Shiga A, Tsujino A, Sugai A, Kato T, Kanai K, Yokoseki A, Eguchi H, Kuwabara S, Nishizawa M, Takahashi H & Onodera O (2012) Japanese amyotrophic lateral sclerosis patients with GGGGCC hexanucleotide repeat expansion in C9ORF72. J. Neurol. Neurosurg. Psychiatry 84: 398–401
- Shiga A, Ishihara T, Miyashita A, Kuwabara M, Kato T, Watanabe N, Yamahira A, Kondo C, Yokoseki A, Takahashi M, Kuwano R, Kakita A, Nishizawa M, Takahashi H & Onodera O (2012) Alteration of POLDIP3 Splicing Associated with Loss of Function of TDP-43 in Tissues Affected with ALS. PLoS One 7: e43120
- Ishihara T, Ariizumi Y, Shiga A, Kato T, Tan C-F, Sato T, Miki Y, Yokoo M, Fujino T, Koyama A, Yokoseki A, Nishizawa M, Kakita A, Takahashi H & Onodera O (2013) Decreased number of Gemini of coiled bodies and U12 snRNA level in amyotrophic lateral sclerosis. Hum. Mol. Genet.: 1-12
- Koyama A, Sugai A, Kato T, Ishihara T, Shiga A, Toyoshima Y, Koyama M, Konno T, Hirokawa S, Yokoseki A, Nishizawa M, Kakita A, Takahashi H & Onodera O (2016) Increased cytoplasmic TARDBP mRNA in affected spinal motor neurons in ALS caused by abnormal autoregulation of TDP-43. Nucleic Acids Res. 44: 5820-5836
- Sugai A, Kato T, Koyama A, Koike Y, Kasahara S, Konno T, Ishihara T & Onodera O (2018) Robustness and vulnerability of the autoregulatory system that maintains nuclear TDP-43 levels: a trade-off hypothesis for ALS pathology based on in silico data. Front. Neurosci. 12: 28
- Sugai A, Kato T, Koyama A, Koike Y, Konno T, Ishihara T & Onodera O (2019) Non-genetically modified models exhibit TARDBP mRNA increase due to perturbed TDP-43 autoregulation. Neurobiol. Dis. 130: 104534
