脳虚血・神経保護研究
脳虚血・神経保護研究
脳血管障害(脳卒中)は,脳の血管がつまる⇒“脳梗塞”か,破れる⇒“脳出血”に大きくは分けられます.日本人の死因の第四位,寝たきりの原因では第一位の疾患です.単に脳血管が障害されるといっても,実はその病態は複雑であること,また,一度発症すると根治が難しいという固定観念から,学問的にも臨床的にもアプローチが難しい分野でした.
しかし,近年CT・MRIや超音波検査を中心とした急速な画像診断学の発達,新たな血栓溶解薬(tPA)の普及,脳血管内カテーテル治療により急性期治療は大きな変換点を迎えております.
私たちは主に,脳卒中の70%を占める脳梗塞の治療を目指した病態解明,治療応用の検討を進めております.以前は急性期の脳保護薬の開発を行っておりましたが,現在では慢性期の機能回復を目指した細胞療法の研究を行っております.いわば,脳の持つ可塑性の機序解明を脳血管障害の病態・治療法開発からアプローチしております.


1.慢性期の機能回復を促進する細胞療法
脳梗塞では,急性期の治療を行っても,半数以上は何らかの後遺症を残します.しかし現在,実臨床で使える機能回復療法は,リハビリのみであり,その効果は限られています.このことから,新たな機能回復療法の確立が求められています.
脳梗塞後の病態には,様々な物質が動的に役割を変化させながら関与します.例えば,物質Aは脳梗塞の急性期には脳梗塞に有害に,慢性期には有益に働く,また物質Bは脳梗塞には有益でも身体の他の部位には有害に働く,といった具合です.このため,単一物質の投与による機能回復療法には限界があります.
そこで我々は,生きた細胞を投与することによる治療,すなわち細胞療法に着目して研究を行なっています.生きた細胞であれば,周囲の環境に柔軟に適応しながら様々な物質を分泌し,治療効果をもたらしえると考えたからです.
脳梗塞後,壊死した組織から分泌される物質は,周囲の炎症細胞を刺激し炎症を引き起こすことによって,さらに組織の破壊を助長します.この炎症を抑えることが,細胞療法の1つ目の治療ターゲットです(図1-①).また壊死した組織は,血管内皮成長因子(VEGF)という物質を分泌し,血管を増やそうとします.この新生血管は神経再生を促すことが知られており,いかに新生血管を増やすかということが,2つ目の治療ターゲットになります(図1-②).そこで我々は以下の2つの細胞療法の開発に取り組んできました.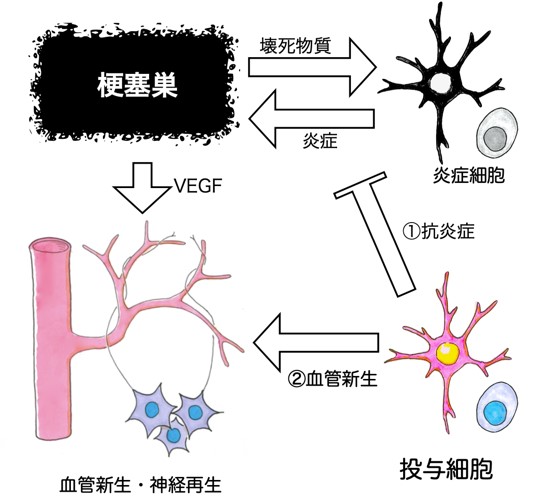
図1.脳梗塞後の組織回復メカニズム
1)低酸素低糖刺激ミクログリア投与による機能回復療法
(第1回 日本脳循環代謝学会 学会賞受賞,日本医師会 医学研究奨励賞 受賞)
ミクログリアは脳に内在する炎症細胞です.ミクログリアは脳梗塞急性期には炎症を惹起し組織を破壊しますが,脳梗塞後しばらく時間が経つと,抗炎症サイトカイン(TGF-β)やVEGFを分泌して,組織を保護する働きを持ち始めます.この生体に内在する保護作用を増強することにより,新しい細胞療法を開発することを着想しました.
ミクログリアに脳梗塞類似の刺激,すなわち低酸素低糖(OGD)刺激を与えると,ミクログリアからのTGF-β・VEGFの分泌が亢進することがわかりました.さらに,脳梗塞を発症したラットにこのミクログリアを投与すると,脳梗塞周囲にミクログリアが集まり,脳内のTGF-β・VEGFが増加し,神経軸索の伸展や血管新生が亢進することがわかりました(図2左).さらに,脳梗塞の後遺症も改善することがわかりました(図2右).
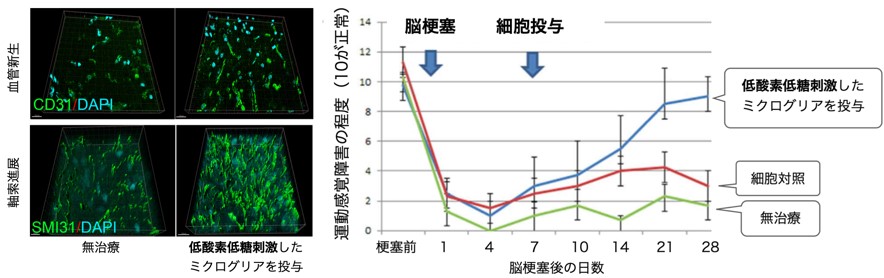
図2.OGD刺激保護的ミクログリア投与による脳梗塞機能回復療法
2)OGD刺激末梢血単核球投与による機能回復療法
(第44回 日本心臓財団 草野賞 受賞)
しかし,ミクログリアは脳内の細胞であり,ヒトから採取することは困難です.一方,末梢血単核球(PBMC)中には,マクロファージなどミクログリアに類似した細胞が存在することがわかっています.このPBMCでもミクログリア同様の治療効果が示されれば,本技術の臨床応用が容易になると考えました.
PBMCにOGD刺激を与えると,ミクログリア同様TGF-β・VEGFの分泌が亢進することがわかりました.さらに,脳梗塞を発症したラットにこのPBMCを投与すると,脳内のTGF-β・VEGFが増加し,神経軸索の伸展や血管新生が亢進することがわかりました(図3左).さらに,脳梗塞の後遺症も改善することがわかりました(図3右).
現在,本技術の臨床応用に向けて,産学官共同の研究が進行中です.
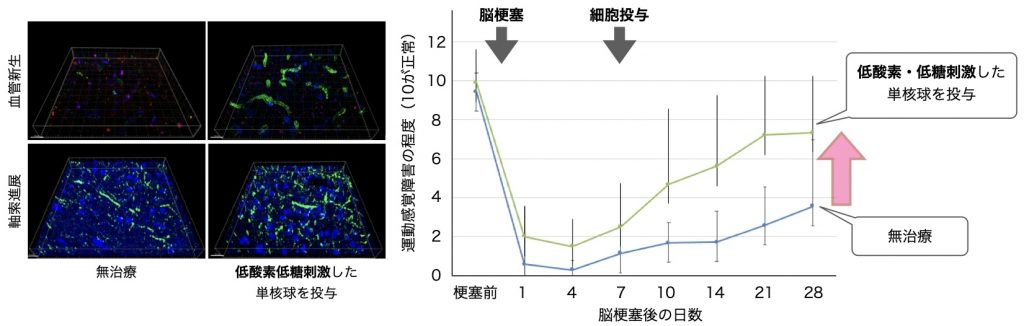
図3 OGD刺激保護的PBMC投与による脳梗塞機能回復療法
2.急性期のtPAに併用する保護薬開発
tPA投与により,閉塞血管を再灌流させ,治療効果を認める例がいる一方で,治療可能時間は発症からわずか4.5時間です.そのため,治療恩恵にあずかれる症例は全脳梗塞例のわずか5~10%です.脳保護薬の開発が,tPA療法の治療可能時間を延ばし,治療患者を増やすという戦略から,保護薬の検討を行ってきました.
1)血管内皮増殖因子(VEGF)の阻害 (第37回日本脳卒中学会・日本心臓財団草野賞受賞)
2)血管安定化因子アンギオポイエチン-1の補充
3)脳保護に関与する成長因子プログラニュリン (第29回成人血管病研究振興財団 岡本研究奨励賞)
2021年の現在では,血管内治療(血栓回収術)が,血栓溶解薬tPAの治療効果に勝ることがわかり,前者がスタンダートになりつつあります.ただし,保護薬併用の私たちが示してきたアイディアは,血管内治療に併用する保護薬の開発にもつながっております(Otsu et al. J Neurol Sci 2020総説参照).
私たちは,基礎研究の病態機序解明から,臨床応用を目指して,検討を進めております.研究グループでは,他大学,他施設とも緊密に共同研究を行っております.
発表論文
- Kanazawa M, Ninomiya I, Otsu Y, Hatakeyama M. Next-generation regenerative therapy for ischemic stroke using peripheral blood mononuclear cells. Neural Regen Res. 2024. in press.
- Akiyama N, Yamashiro T, Ninomiya I, et al. Neuroprotective effects of oral metformin before stroke on cerebral small-vessel disease. J Neurol Sci. 2024;456:122812.
- Ninomiya I, Koyama A, Otsu Y, et al. Regeneration of the cerebral cortex by direct chemical reprogramming of macrophages into neuronal cells in acute ischemic stroke. Front Cell Neurosci. 2023;17:1225504.
- Otsu Y, Hatakeyama M, Kanayama T, et al. Oxygen-Glucose Deprived Peripheral Blood Mononuclear Cells Protect Against Ischemic Stroke. Neurotherapeutics. 2023;20:1369-1387.
- Otsu Y, Namekawa M, Toriyabe M, et al. Strategies to prevent hemorrhagic transformation after reperfusion therapies for acute ischemic stroke: A literature review. J Neurol Sci. 2020;419:117217.
- Hatakeyama M, Ninomiya I, Otsu Y, et al. Cell Therapies under Clinical Trials and Polarized Cell Therapies in Pre-Clinical Studies to Treat Ischemic Stroke and Neurological Diseases: A Literature Review. Int J Mol Sci. 2020;21:6194.
- Ninomiya I, Kanazawa M, Uemura M, et al. Elevated serum pentraxin 3 levels might predict the diagnosis of branch atheromatous disease at a very early stage. Eur J Neurol. 2020;27:1279-1284.
- Hatakeyama M, Ninomiya I, Kanazawa M. Angiogenesis and neuronal remodeling after ischemic stroke. Neural Regen Res. 2020;15:16-19.
- Hatakeyama M, Kanazawa M, Ninomiya I, et al. A novel therapeutic approach using peripheral blood mononuclear cells preconditioned by oxygen-glucose deprivation. Sci Rep. 2019;9:16819.
- Kanazawa M, Takahashi T, Ishikawa M, et al. Angiogenesis in the ischemic core: A potential treatment target? J Cereb Blood Flow Metab. 2019;39:753-769.
- Izawa Y, Gu YH, Osada T, Kanazawa M, et al. β1-integrin-matrix interactions modulate cerebral microvessel endothelial cell tight junction expression and permeability. J Cereb Blood Flow Metab. 2018;38:641-658.
- Kanazawa M, Ninomiya I, Hatakeyama M, et al. Microglia and monocytes/macrophages polarization reveal novel therapeutic mechanism against stroke. Int J Mol Sci. 2017;18:E2135.
- Kanazawa M, Miura M, Toriyabe M, et al Microglia preconditioned by oxygen-glucose deprivation promote functional recovery in ischemic rats. Sci Rep. 2017;7:42582.
- Kanazawa M, Takahashi T, Nishizawa M, et al. Therapeutic strategies to attenuate hemorrhagic transformation after tissue plasminogen activator treatment for acute ischemic stroke. J Atheroscler Thromb 2017;24:240-253.
- Gu YH, Kanazawa M, Hung SY, et al. Cathepsin L acutely alters microvessel integrity within the neurovascular unit during focal cerebral ischemia. J Cereb Blood Flow Metab. 2015;35:1888-1900.
- Kanazawa M, Kawamura K, Takahashi T, et al.. Multiple therapeutic effects of progranulin on experimental acute ischaemic stroke Brain 2015;138:1932-1948.
