神経免疫研究
免疫性神経疾患とは?(多発性硬化症,視神経脊髄炎など)
多発性硬化症(multiple sclerosis: MS)
概要
多発性硬化症は空間的多発性と時間的多発性をもって中枢神経が障害される自己免疫疾患である. 発症のピークは20~30歳で, 女性が男性の2〜3倍である. 北米や北欧など高緯度地域に多く, 白人に有病率が高い. しかし近年, 日本でも有病率が年々上昇してきている. 環境的要因と遺伝的要因が関与する多因子疾患と考えられている. 環境的要因として,Epstein-Barr virus感染,血中ビタミンD濃度の低下,喫煙が知られている.遺伝的要因として, HLA-DRB1*15:01が最も強い疾患感受性遺伝子として同定されているが, その他にも多数のMS関連遺伝子が指摘されている. 病早期には, 視力・視野障害, 複視, 運動麻痺, 感覚障害が発作的に生じ, また症状が軽快・消失する経緯を繰り返すことが多い(再発寛解型多発性硬化症). 欧州の自然歴研究により, 疾患修飾薬による治療を行わない場合, 約10年後に, 半数が徐々に日常生活動作が制限され,認知機能障害が加わる進行型多発性硬化症へ移行すると考えられている. 対応自己抗原を含め, 原因は不明であるが, 病早期はリンパ球による炎症が主体で, 進行期は自然免疫細胞による神経変性にシフトすると考えられている. 早期に再発を抑える疾患修飾薬を用いて二次進行型への移行を遅らせることが,現在の治療のスタンダードである.
症状
視神経炎による視力低下や中心暗点, 脳幹病変による複視, 脊髄病変による運動麻痺や感覚障害, 排尿障害がみられる. これらは数日から1週間の経過で増悪するが, 自然に軽快することが多い. 多幸症やうつ状態などの精神症状もみられる. 多発性硬化症に典型的な症候として, 頸部の前屈によって背部~下肢に電撃様しびれ感が放散するLhermitte徴候, 発作的に四肢の痛みと痙攣が起こる有痛性強直性痙攣, 入浴後や発熱時に症状が悪化するUhthoff現象などがある. 進行型多発性硬化症では, 罹病期間が長くなるにつれて脳の萎縮が進み, 注意力の低下や情報処理速度の低下などの認知機能障害がみられる場合がある.
検査所見
脳脊髄液検査では, 増悪期に軽度の細胞増多と総蛋白増加, 髄鞘塩基蛋白の上昇がみられる. 中枢神経における抗体産生を反映して, IgG indexの上昇やオリゴクローナルバンドがみられる. 頭部MRIでは脳室周囲や皮質近傍に卵円形病変 (ovoid lesion) が散在し, 側脳室壁に垂直に伸びるものはDawson’s fingerと呼ばれる. 急性増悪期の病変はガドリニウム造影T1強調画像で増強され, 円形病変の一部が開いて造影されるopen-ring signを呈することがある. 脊髄MRIでは, 病変の長さは1椎体長前後で, 前索・側索・後索など白質優位に分布し, 横断性になることは少ない. 視覚誘発電位と体性感覚誘発電位では, 視神経から後頭葉に至る視覚路や, 四肢から一次感覚野に至る経路の潜在性病変を見出し, 空間的多発性を証明する一助となる.
診断
多発性硬化症には未だに特異的なマーカーは存在しないため,様々な他の神経疾患(感染症や他の自己免疫疾患など)を除外した上で, McDonald診断基準を適応する (‘No better explanation’).
表1.McDonald診断基準(2010年)
| 臨床像 | 診断に必要な追加事項 |
|---|---|
| 2回以上の増悪と2個以上の臨床的他覚的病巣(1回の増悪でも病歴で増悪を示唆するものがあればよい) | なし*1 |
| 2回以上の増悪と1個の臨床的他覚的病巣 | MRIによる「空間的多発性(DIS)」の証明(表2) または 他の病巣に由来する臨床的増悪 |
| 1回の増悪と2個以上の臨床的他覚的病巣 | MRIによる「時間的多発性(DIT)」の証明(表3) または 2回目の臨床的増悪 |
| 1回の増悪と1個の臨床的他覚的病巣(CIS) | MRIによる「空間的多発性(DIS)」の証明 (表2) または 他の病巣に由来する臨床的増悪 および MRIによる「時間的多発性(DIT)」の証明 (表3) または 2回目の臨床的増悪 |
| MSを示唆する進行性の増悪(一次進行型) |
1年間の進行性の増悪.そして以下のうちの2つ
|
CIS: clinically isolated syndrome,*1:多発性硬化症と診断するためには他の疾患を完全に否定し,すべての所見が多発性硬化症にむじゅんしないものでなければならない.*2:造影効果の有無は問わない,*3:脳脊髄液所見陽性とは,等電点電気泳動法によるオリゴクローナルバンドあるいはIgG index高値をいう.
表2.空間的多発性 (dissemination in space; DIS) の証明
|
下記のいずれかを満たせば証明される
|
*:造影効果の有無は問わない.
表3.時間的多発性 (dissemination in time; DIT) の証明
|
下記のいずれかを満たせば証明される
|
*:造影効果の有無は問わない.
治療
NEDA(no evidence of disease activity)という概念があり, 症状を伴う再発がないこと, MRI上の活動性がないこと, EDSS (Expanded Disability Status Scale) スコアの進行がないこと, 脳や脊髄の萎縮がないこと, これら4つが治療の目標である. 再発寛解型多発性硬化症では, 急性増悪期にステロイドパルス療法や血液浄化療法を行い,その後にインターフェロンβ,グラチラマー酢酸塩,フィンゴリモド, ナタリズマブなどの疾患修飾薬によって再発抑制を行う(2016年10月現在).副作用としては, インターフェロンβでは投与開始初期のインフルエンザ症状, 間質性肺炎やうつ, グラチラマー酢酸塩では注射部位反応, フィンゴリモドでは投与直後の徐脈, 肝障害, 黄斑変性, リンパ球数の減少, 水痘・帯状疱疹ウイルス感染症の再燃などがある. フィンゴリモドやナタリズマブでは未だ根治的治療のない進行性多巣性白質脳症が報告されており, より一層の注意を要する. なお, 現時点で進行型多発性硬化症を改善する疾患修飾薬は日本にはなく, 世界中でアンメット・メディカル・ニーズの高い分野として薬剤開発が盛んに試みられつつある.
多発性硬化症は若年女性での発症が多いため, 薬剤の胎児への影響や周産期対応は極めて重要である. 米国食品医薬品局(FDA)薬剤胎児危険度分類基準によれば, グラチラマー酢酸塩はカテゴリーB (ヒトでの危険性の証拠はない), 副腎皮質ステロイド, インターフェロンβ, フィンゴリモド, ナタリズマブがカテゴリーC (危険性を否定できない) で, グラチラマー酢酸塩は比較的安全と考えられる. 多発性硬化症では妊娠中は再発率が減少するため, 妊娠がわかった時点で薬剤を中止する場合もあるが, 疾患活動性が高い例では薬剤の継続も考慮する. また, 出産後3ヶ月間は再発率が増加するため,出産後は速やかに疾患修飾薬を再開することが望ましいとされる.
なお, 平成27年1月1日から「難病の患者に対する医療等に関する法律」に基づき, 新たな特定疾患医療費助成制度が始まり, 多発性硬化症では重症度分類であるEDSSスコア4.5以上が助成の対象となっている(平成28年10月現在).
視神経脊髄炎 (neuromyelitis optica; NMO) spectrum disorders (NMOSD)
概要
視神経脊髄炎は中枢神経系のアストロサイトの血管足突起に存在するアクアポリン4 (AQP4) 水チャネルを標的抗原とする炎症性自己免疫疾患である. 発症のピークは35歳~45歳で, 女性が男性の9〜10倍多いとされる. 日本をはじめとしたアジアや南米で有病率が高い. 発作的に視神経炎や脊髄炎が起こり, 一度の増悪によって重篤な身体機能障害を残す場合がある. 近年, 特異的な診断バイオマーカーであるAQP4抗体が発見され, 典型的症候を持つ例にとどまらず, 症候の揃っていない空間的限局例や早期例においても診断が可能になった. これらを背景に, AQP4抗体陽性という共通した免疫病態として包括的に定義した概念「NMO spectrum disorders (NMOSD)」が提唱された. NMOSDの急性期治療はステロイドパルス療法(一部の症例で血漿交換療法が併用される場合がある)で, 再発抑止には経口ステロイド薬が用いられる. なお, 多発性硬化症の再発抑制に用いるインターフェロンβ, フィンゴリモド, ナタリズマブは, NMOSDを悪化させる可能性があるため, 使用されない.
症状
視神経炎と脊髄炎を大きな二つの症候である. 片側もしくは両側の視神経炎による高度の視力・視野障害がみられ, 視交叉や視索に及ぶと両耳側半盲や水平半盲を呈する. 脊髄炎も重篤であることが多く, 対麻痺, 感覚障害, 排尿障害がみられる. その他, 脳幹病変による複視, 延髄最後野病変による難治性の吃逆, 視床下部病変による症候性ナルコレプシー, 大脳病変による意識障害などが知られている.
検査所見
血清AQP4抗体が陽性であるが, 一部の症例ではAQP4抗体は陰性の場合がある. このため, 一回の測定で陰性であっても, 繰り返し測定することが必要な場合がある. 他の自己抗体 (抗核抗体,抗甲状腺ペルオキシダーゼ抗体,抗サイログロブリン抗体,抗SS-A抗体,抗SS-B抗体など) が陽性になることがある. 脳脊髄液検査では,増悪期に多形核球を含む細胞増多がみられる. IgG indexは正常で, オリゴクローナルバンドの陽性率は多発性硬化症と比較して低い. 眼窩MRIでは, 長い病変で,視交叉に及ぶ病変がみられる場合がある. 脊髄MRIでは3椎体以上の長椎体脊髄病変 (longitudinally extended transverse myelitis [LETM]) が典型的で, 病変は中心灰白質優位に分布し, 腫張を伴い, ガドリニウム造影T1強調画像で増強されることが多い. 頭部MRIでは延髄背側または最後野の病変, 第4脳室上衣周囲の脳幹病変, 視床または視床下部病変, 広範な皮質下白質または深部白質病変, 内包や大脳脚にわたる長い皮質脊髄路病変, 脳梁の長さ1/2以上にわたる浮腫状かつ不均一な病変がみられる場合がある. またMSと区別できない非特異的病変を大脳白質に認めることがある.
診断
成人NMOSD国際診断基準(2015年基準)で診断されることが多い(表).
表1. 成人NMOSDの2015年診断基準
| AQP4抗体陽性のNMOSD |
|---|
| 1. 中核となる臨床的特徴 (表2) が少なくとも1つある |
| 2. AQP4抗体陽性である (cell-based assay法が強く推奨される) |
| 3. 他の疾患を除外する (表3; red flags) |
| AQP4抗体陰性・未測定のNMOSD |
| 1. 中核となる臨床的特徴 (表2) が2つ以上あり,以下をすべて満たす |
| ・ 中核となる臨床的特徴 (表2) の1つは,視神経炎,急性脊髄炎,延髄最後野症候群である |
| ・空間的多発の証明 (中核となる臨床的特徴 [表2] が2種類以上ある) |
| ・MRIの必要条件 (表2) を満たす |
| 2. AQP4抗体陰性またはAQP4抗体未測定である |
| 3. 他の疾患を除外する (表3; red flags) |
表2. 成人NMOSDの2015年診断基準の追記事項
| 中核となる臨床的特徴 |
|---|
|
| MRIの追加必要条件 |
|
表3. 成人NMOSDの2015年診断基準におけるred flags
| Red flags (臨床・検査所見) |
|---|
|
| Red flags (画像所見) |
|
治療
NMOSDの急性期治療の第一選択はステロイドパルス療法で,効果が乏しい例や重症例では血液浄化療法が行われることがある. 再発抑制の第一選択は経口プレドニゾロンである. 経口プレドニゾロン単独で再発が抑制されない場合, 免疫抑制薬を併用されることもある.なお,多発性硬化症の再発抑制に用いるインターフェロンβ,フィンゴリモド,ナタリズマブは,NMOSDを悪化させる可能性があるため使用を控える. NMOの慢性期神経後遺症には対症療法とリハビリテーションが有効な場合がある. 現時点ではNMOに承認されている薬剤はない. ガイドラインに沿った治療法の選択が望まれる.
参考図書,参考文献
- 神経内科ハンドブック―鑑別診断と治療,第5版,水野美邦(編),医学書院,2016
- 多発性硬化症治療ガイドライン2010,「多発性硬化症治療ガイドライン」作成委員会(編),日本神経学会・他(監),医学書院,2010
- 多発性硬化症治療ガイドライン2010追補版,「多発性硬化症治療ガイドライン」作成委員会(編),日本神経学会・他(監),医学書院,2010
- 標準神経治療:視神経脊髄炎(NMO),神経治療Vol.30 No.6,日本神経治療学会治療指針作成委員会(編), 2013
- Polman CH , et al. Annals of Neurology 2011;69(2): 292-302. (2010年McDonald診断基準)
- Wingerchuk DM, et al. Neurology 2015;14;85(2):177-89. (2015年NMOSD診断基準)
- Miller DH, et al. Multiple Sclerosis Journal 2008;14(9):1157-74. (MS鑑別診断のための系統的アプローチ方法)
免疫性神経疾患の研究
神経免疫チームは, 多発性硬化症や視神経脊髄炎を含む様々な免疫性神経疾患の臨床研究と基礎研究を行っています. 免疫性神経疾患のリンパ球やMRI画像を解析して, 多発性硬化症や視神経脊髄炎の発症機序を明らかにするための研究 (どのように病気が発症するのかを明らかにする研究), 治療反応性や活動性を推定するマーカーの開発, 新規治療法の開発などを進めています. 特に世界的に多数のリソース資源を有する当研究所病理学部門と連携した研究, 国際共同研究による新たな病態機序の解明 (北米と欧州), 国際共同治験による新たな疾患修飾薬の開発に力を注いでいます. 臨床研究と基礎研究の両者を行い, 「免疫学的隔絶部位・脳における自己免疫病態の解明」と「患者の役に立つ研究」を目指しています. 近年の主な研究成果は以下です.
チームメンバー紹介
河内泉 (PI)
多発性硬化症, 視神経脊髄炎をはじめとした免疫性神経疾患の臨床研究と基礎研究を行っています. 神経システムと免疫システムの両視点から神経疾患を検討すると, 様々な新たな事象が見えてきます. 新潟から世界へ, 患者さんの役に立つ研究を目指し, 日夜, チームメンバーと共に頑張っています. 新潟, 日本はもとより, 国際的ネットワークを活用し, 脳研究の長い歴史を持つ新潟大学脳研究所ならではと言える病態研究・治療開発を推進しています.
柳川香織
多発性硬化症, 視神経脊髄炎をはじめとした免疫性神経疾患の診療を行っています.
佐治越爾
神経免疫疾患の患者さんを中心に診療をしています. 病棟では指導医としてレジデントとともに入院患者さんに治療に当たっています. 臨床治験なども担当させていただいています. 研究室では大学院生とともに, 患者さんにより良い治療が届けられるよう研究しています.
穂苅万李子
脳神経内科に入局し, 患者様達との出会いを経て神経免疫チームで研究を始めました. 視神経脊髄炎, 多発性硬化症の病態解明を大きな目標に, 患者様のQOLや予後改善に役立つ研究を続けていきたいと考えています. 子育てをしながらですが, チームの先生方の暖かいサポートもありますので, 目標に向かって一歩一歩頑張っていきたいです.
柳村文寛(大学院生)
初期臨床研修で視神経脊髄炎の患者さんを診察した経験をもとに,神経免疫学の研究を始めました.フローサイトメトリーや免疫染色によって,中枢神経系におよぶ多様な免疫細胞を解析しています.研究を患者さんの治療に繋げることが目標です.
若杉尚宏(大学院生)
大学病院での病棟で神経疾患の診療に携わりながら, 免疫性神経疾患を中心に研究を始めました. 臨床と研究を結びつけ, 神経疾患の治療法開発に携わっていきたいと考えています.
Alumni
横関明子 (木戸病院神経内科), 荒川武蔵 (新潟医療センター神経内科)
多発性硬化症, 視神経脊髄炎の研究
視神経脊髄炎の限局型脊髄病変における臨床免疫病理学的解析
視神経脊髄炎は主に視神経と脊髄に病変が出現し, 視力障害・歩行障害など重度の後遺症を来すこともある疾患です. アストロサイトに発現しているアクアポリン (AQP4) 水チャネルに反応する自己抗体「AQP4抗体」が体内で産生され, アストロサイトを傷害することで神経症状が出現します. 我々は脊髄炎のみしか症状を出していないいわゆる「限局型視神経脊髄炎」の病理学的解析を行い, 特徴的なAQP4水チャネルの広範な染色性低下を確認しました. 脊髄炎のみの限局型であっても, 視神経炎と脊髄炎を呈する完全型であっても同じ病態が存在することを明らかにしました.
Yanagawa K, Kawachi I, Toyoshima Y, Yokoseki A, Arakawa M, Hasegawa A, Ito T, Kojima N, Koike R, Tanaka K, Kosaka T, Tan CF, Kakita A, Okamoto K, Tsujita M, Sakimura K, Takahashi H, Nishizawa M. Pathologic and immunologic profiles of a limited form of neuromyelitis optica with myelitis Neurology. 2009 Nov 17;73(20):1628-37.
視神経脊髄炎・多発性硬化症の認知機能障害の臨床病理学的解析
多発性硬化症と視神経脊髄炎の認知機能障害の詳細とその病態背景は明らかにしました. 欧米で使用されている「Brief Repeatable Battery of Neuropsychological Tests in Multiple Sclerosis (MSのための神経心理学的簡易反復検査)」の日本語版を用いて認知機能を解析すると, 多発性硬化症と視神経脊髄炎では注意力を含めた認知機能が低下していました. 一方, 病理学的な解析からは, 大脳皮質に多くの脱髄病変を認める多発性硬化症とは対照的に, 視神経脊髄炎の大脳皮質には脱髄はなく, AQP4水チャネル分子の異常と神経細胞の減少を認めました. 以上から, 多発性硬化症と視神経脊髄炎では異なる機序により大脳皮質病変が出現し,脳機能変化を生じる可能性が示唆されました. 多発性硬化症と視神経脊髄炎は, 再発を引き起こす免疫病態だけではなく, 神経を変性させる病態機序も異なる疾患であることが証明されました.
多発性硬化症と視神経脊髄炎の認知機能障害は, 「もの忘れ」を主徴とするアルツハイマー病などの認知症の症状とは異なります. 知的能力・注意力・判断力・記憶力・遂行機能などの認知機能のうち, 多発性硬化症と視神経脊髄炎では特に注意力が障害されるので, 物事に注意を向けられない, 集中できない, 計画を立てて行動することが難しい, 判断するのに時間がかかる, 仕事の効率が落ちる, 疲れやすいなどの症状が生じることがあります. 障害が軽い場合には, 外からはわかりにくく, 周囲の理解が得られにくい「隠れた障害」ともいわれます. 多発性硬化症と視神経脊髄炎は若年成人に多い神経難病であることから, 患者さんにとっては就労や就学に支障をきたすことがあります. 身体機能障害と認知機能変化を早期から評価し, 適切な治療法を早期から選択することができれば, 重症化を予防でき,患者さんと家族の生活の質が維持され, 就学や就労が可能になると期待されます(ニュースリリース).
図1.視神経脊髄炎と多発性硬化症では注意力が低下することがある
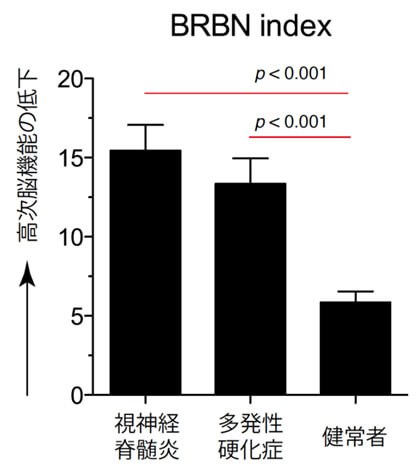
図2.視神経脊髄炎の大脳皮質ではアクアポリン4分子に異常がある
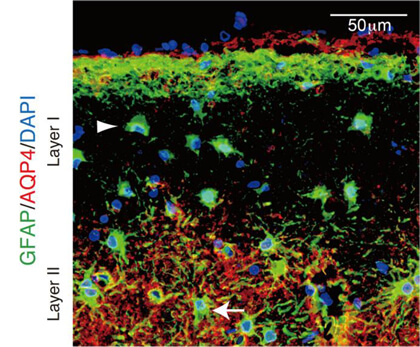
Saji E, Arakawa M, Yanagawa K, Toyoshima Y, Yokoseki A, Okamoto K, Otsuki M, Akazawa K, Kakita A, Takahashi H, Nishizawa M, Kawachi I. Cognitive impairment and cortical degeneration in neuromyelitis optica. Ann Neurol. 2013 Jan;73(1):65-76
視神経脊髄炎の視機能障害の臨床免疫病理学的解析
視神経脊髄炎で「異常なミトコンドリアの集積を伴う 重い神経障害」が生じることを世界で初めて明らかにしました. 従来の免疫制御治療に加え, ミトコンドリアを標的とした新たな神経保護治療の開発に繋がる可能性があります.
1) 多発性硬化症と視神経脊髄炎では視力障害がしばしば起こります. 視神経脊髄炎では多発性硬化症に比較して, より重度で, 回復が不良な視力障害に進展します. 多発性硬化症のミエリン障害, 視神経脊髄炎のアストロサイト障害に加え, 視神経軸索と網膜の神経細胞が強く変性していることを明らかにしました.
2) 多発性硬化症では「未知の異常な免疫因子」によるミエリンの破壊に引き続き, 神経変性が起こります. 視神経脊髄炎では「アクアポリン4抗体」によるアストロサイトの破壊に引き続き, 神経変性が引き起こります. 障害された神経軸索には, 変性したミトコンドリアや陽イオンチャネルtransient receptor potential cation channel subfamily M member 4 (TRPM4) が異常に集積しており, 多発性硬化症と視神経脊髄炎の神経軸索減少に関与していることがわかりました. 神経軸索の障害は, 網膜の神経細胞にも変化を及ぼすことがわかりました. 特にNMOでは, MSと比較して, より多くの異常なミトコンドリアが変性した神経軸索に含まれるため, (1)異常な免疫分子・アクアポリン4抗体の産生を抑制するための免疫制御治療だけではなく, (2)ミトコンドリアと陽イオンチャネルを制御する神経保護治療が有効である可能性が示唆され, その開発が期待されます.
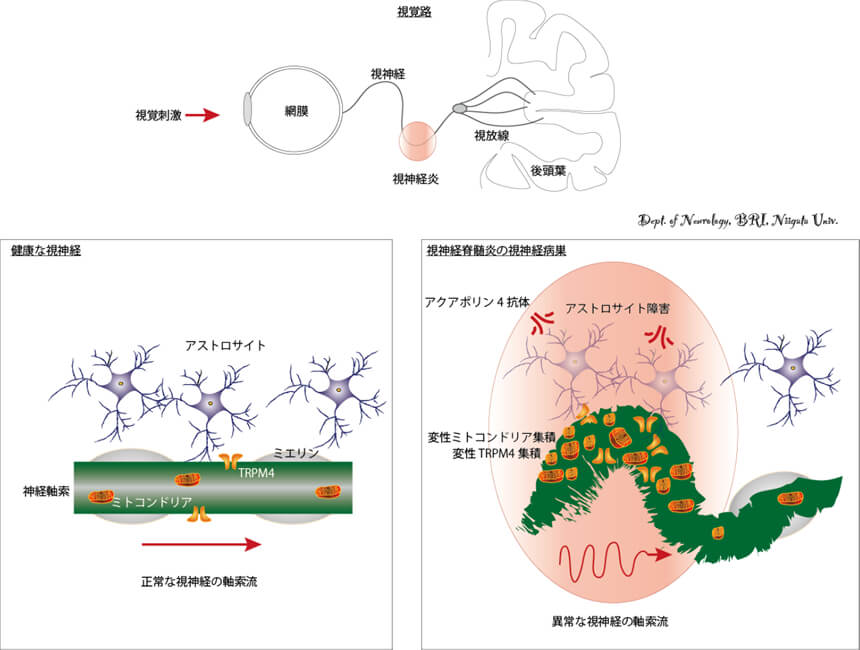
【図】健康な視神経では, 正常なアストロサイトが神経軸索やミエリンをサポートし, 正常なミトコンドリアと正常な陽イオンチャネルtransient receptor potential cation channel subfamily M member 4(TRPM4), 正常な軸索流が, 正常な軸索伝導を形成し, 視覚刺激を網膜から脳まで伝えます. 一方, NMOでは, 異常な免疫分子・アクアポリン4抗体がアストロサイトを破壊します. 神経軸索をサポートする役目を持つアストロサイトが破壊されることにより, 変性したミトコンドリアと変性したTRPM4分子が軸索に蓄積し, 軸索は腫大し, 異常な軸索流となり, 視覚刺激は網膜から脳まで伝わらなくなり, 視力の傷害が出現します. 研究成果は臨床神経学分野で権威あるAnnals of Neurology誌のオンライン版に掲載されました(ニュースリリース).
Hokari M, Yokoseki A, Arakawa M, Saji E, Yanagawa K, Yanagimura F, Toyoshima Y, Okamoto K, Ueki S, Hatase T, Ohashi R, Fukuchi T, Akazawa K, Yamada M,Kakita A, Takahashi H, Nishizawa M, Kawachi I. Clinicopathological features in anterior visual pathway in neuromyelitis optica. Ann Neurol. 2016 Apr;79(4):605-24.
多発性硬化症の髄液リンパ球特性の解析
フィンゴリモド (ジレニア®, イムセラ®) は多発性硬化症の新規疾患修飾薬です. フィンゴリモドはスフィンゴシン1-リン酸 (S1P) 受容体に対するアンタゴニストで, リンパ球を二次リンパ組織内に閉じ込める作用を持ち, 多発性硬化症におけるリンパ球の中枢神経への侵入を抑制し, 効果を発揮すると考えられています. フィンゴリモドはCCR7陽性セントラルメモリーT細胞を二次リンパ組織に閉じ込めることで, 中枢神経への侵入を抑制し, 多発性硬化症の再発を抑制すると考えられています. フィンゴリモド治療開始直後に, 末梢血中のリンパ球は速やかに低下しますが, 脳MRI造影病変数はゆっくりと改善をはじめ, 約半年以後に安定した再発抑制作用を発揮します. しかしなぜフィンゴリモド開始早期に多発性硬化症を再発することがあるのか, 血液や髄液の詳細なセントラルメモリーT細胞の動態解析はなされておりません. そこで我々はフィンゴリモド導入早期に再発した多発性硬化症症例の臨床的・免疫学的リンパ球動態を明らかにすることを目的とし, フロサイトメーターを用いた血液・髄液リンパ球動態の解析を行いました. フィンゴリモド治療開始後, 再発・非再発例ともに, 血液ではリンパ球数, CD4陽性T細胞数の減少, CD4/8比の低下, CCR7陽性セントラルメモリーT細胞の減少を認めました. 一方, 髄液のCCR7陽性セントラルメモリーT細胞は非再発例では減少しているのに対し, 再発例では減少せず残存していました. 今回の結果から, (1) フィンゴリモドは治療早期に血液と髄液の免疫細胞に異なる作用, もしくは異なる時間的変化をもたらす可能性があること, (2) 血液のリンパ球, CCR7陽性セントラルメモリーT細胞はフィンゴリモド治療中の疾患活動性の指標にならないこと, (3) むしろ髄液のCCR7陽性セントラルメモリーT細胞が疾患活動性の指標になる可能性があること, (4) フィンゴリモド治療早期には再発に注意する必要があると考えられました. 今後, このような解析を通して, 多発性硬化症患者さん一人一人により最適な治療法を選択できることが期待されます.
Yokoseki A, Saji E, Arakawa M, Hokari M, Ishiguro T, Yanagimura F, Ishihara T,Okamoto K, Nishizawa M, Kawachi I. Relapse of multiple sclerosis in a patient retaining CCR7-expressing T cells in CSF under fingolimod therapy. Mult Scler. 2013 Aug;19(9):1230-3
自己免疫性脳炎の研究
抗神経抗体
傍腫瘍性神経症候群は, 担癌患者で, 癌そのものの転移ではなく, 癌細胞による遠隔効果により自己免疫学的機序で特異な神経症状を生じる疾患です. 悪性腫瘍の原発組織と臨床病型に関連して特徴的な抗神経抗体が検出されます. 本症は過半数において神経症状が悪性腫瘍発見に先立つことから, 本症の診断は腫瘍の早期発見にもつながる重要な意味を持っています. 当科では傍腫瘍性神経症候群が世に知られるようになった黎明期から, 本症候群の診断システムの構築およびその病態機序解明の研究を続けており, 本症の診断マーカーとなる特異抗体が認識する抗原を蛋白レベルで始めて報告し, その後明らかになった数種の自己抗体の特異的検出システムを構築し, 本症および潜在する悪性腫瘍の診断に寄与してきました.
新規神経細胞表面抗体
近年, 神経細胞の表面に反応する新規自己抗体が同定され, その臨床症状の特徴や治療反応性が次々と報告されています. その代表としてNMDA受容体抗体があり, 近年, 報告数が急増しています. またAMPA受容体, GABA(A)受容体, GABA(B)受容体, LGI1, CASPR2, mGluR5, Gly受容体, DPPX, IgLON5などの自己抗体が報告されています. 欧州と国際共同研究を継続的に行い, NMDA受容体やNeurexin-3に対する自己抗体を持つ脳炎の詳細を明らかにしています.
Titulaer MJ, McCracken L, Gabilondo I, Armangué T, Glaser C, Iizuka T, Honig LS, Benseler SM, Kawachi I, Martinez-Hernandez E, Aguilar E, Gresa-Arribas N, Ryan-Florance N, Torrents A, Saiz A, Rosenfeld MR, Balice-Gordon R, Graus F, Dalmau J. Treatment and prognostic factors for long-term outcome in patients with anti-NMDA receptor encephalitis: an observational cohort study. Lancet Neurol. 2013 Feb;12(2):157-65.
Gresa-Arribas N, Planagumà J, Petit-Pedrol M, Kawachi I, Katada S, Glaser CA,Simabukuro MM, Armangué T, Martínez-Hernández E, Graus F, Dalmau J. Human neurexin-3α antibodies associate with encephalitis and alter synapse development. Neurology. 2016 Jun 14;86(24):2235-42.
Titulaer MJ, McCracken L, Gabilondo I, Iizuka T, Kawachi I, Bataller L, Torrents A, Rosenfeld MR, Balice-Gordon R, Graus F, Dalmau J. Late-onset anti-NMDA receptor encephalitis. Neurology. 2013 Sep 17;81(12):1058-63.
Kawachi I, Saji E, Toyoshima Y, Dalmau J, Nishizawa M. Treatment responsive opsoclonus-ataxia associated with ovarian teratoma. J Neurol Neurosurg Psychiatry. 2010 May;81(5):581-2.
肥厚性硬膜炎の研究
肥厚性硬膜炎とは脳や脊髄を包んでいる硬膜に慢性的な炎症が起き, 硬膜が肥厚する病気です. これまでに, 結核や真菌症などの感染症, 膠原病をはじめとする自己免疫疾患 (自分の身体を攻撃する免疫成分を持ち, そのアンバランスが病因と考えられる疾患) などが原因となって発症することが知られていましたが, その特徴と病態は十分にわかっていませんでした. 我々は好中球に対する自己抗体 (抗好中球細胞質抗体; ANCA), 中でもミエロペルオキシダーゼ (MPO) に対する自己抗体 (MPO-ANCA) に関連した自己免疫性肥厚性硬膜炎を解析し, 以下の点を明らかにしました.
1) 中高年女性に多い,2) 多発血管炎性肉芽腫症 (Granulomatosis with Polyangiitis; GPA) (旧称; ウェゲナー肉芽腫症) の中枢神経病変の一つである, 3) 中耳炎をはじめとした上気道炎を併発することが多い, 4) 硬膜と上気道に病変が限局する限局型が多く, 腎臓や肺に病変を持つ全身型に進展することは少ない, 5) 肥厚した硬膜にはTh1型免疫細胞を含む炎症性肉芽とリンパ濾胞構造を認め, その場で自己抗体が産生されている可能性が高い, 6) 副腎皮質ステロイド剤とサイクロフォスファミドを併用した治療が有効である. 以上から, 本邦で自己免疫性肥厚性硬膜炎の約半数を占める「MPO-ANCAに関連した肥厚性硬膜炎」は, 「GPA・ANCA関連血管炎の重要な中枢神経病変の一つであり, GPAと同様に, 副腎皮質ステロイド剤とサイクロフォスファミド併用療法が有効である」と考えられました. 本研究は, 肥厚性硬膜炎の疾患概念の確立にとどまらず, 血管炎症候群の新たな免疫病態の解明に貢献すると考えられます.
図. MPO-ANCA陽性肥厚性硬膜炎の頭部MRI画像
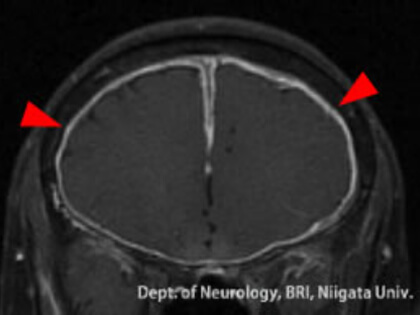
Yokoseki A, Saji E, Arakawa M, Kosaka T, Hokari M, Toyoshima Y, Okamoto K,Takeda S, Sanpei K, Kikuchi H, Hirohata S, Akazawa K, Kakita A, Takahashi H,Nishizawa M, Kawachi I. Hypertrophic pachymeningitis: significance of myeloperoxidase anti-neutrophil cytoplasmic antibody. Brain. 2014 Feb;137(Pt 2):520-36.
ラボミーティング
神経免疫チームでは,週1回,約3時間のラボミーティングを行っています. 研究成果のレビュー, 抄読会,個別の研究審議から成ります. 自身の研究テーマに関わる論文をスライドにまとめ,プレゼンテーションを行います.抄読会では多発性硬化症や視神経脊髄炎に関する論文や,神経学や免疫学に関する論文を紹介します. 盛んに質問がでて, 免疫学と神経科学のUP-TO-DATEが報告されます. 和気藹々とした雰囲気で, 楽しい時間です.
最近の主要な業績
2016年度
- Kawachi I, Lassmann H. Neurodegeneration in multiple sclerosis and neuromyelitis optica. J Neurol Neurosurg Psychiatry online first, published on September 26, 2016. 10.1136/jnnp-2016-313300.
- Gresa-Arribas N, Planagumà J, Petit-Pedrol M, Kawachi I, Katada S, Glaser CA, Simabukuro M M, Armangué T, Martinez-Hernandez E, Graus F, Dalmau J. Human neurexin-3 antibodies associate with encephalitis and alter synapse development. Neurology 2016;86:1-8.
- Tsuboguchi S, Yajima R, Higuchi Y, Ishikawa M, Kawachi I, Koyama Y, Nishizawa M. A case of slowly progressive anti-Yo-associated paraneoplastic cerebellar degeneration successfully treated with antitumor and immunotherapy. Rinsho Shinkeigaku. 2016 Jun 30. [Epub ahead of print]. DOI: 10.5692/clinicalneurol.cn-000872.
- Misawa S, Sato Y, Katayama K, Nagashima K, Aoyagi R, Sekiguchi Y, Sobue G, Koike H, Yabe I, Sasaki H, Watanabe O, Takashima H, Nishizawa M, Kawachi I, Kusunoki S, Mitsui Y, Kikuchi S, Nakashima I, Ikeda S, Kohara N, Kanda T, Kira J, Hanaoka H, Kuwabara S, for the Japanese POEMS Syndrome for Thalidomide (J-POST) Trial Study Group. Safety and efficacy of thalidomide in patients with POEMS syndrome: a multicentre, randomised, double-blind, placebo-controlled trial. Lancet Neurol 2016. Published Online August 2, 2016. http://dx.doi.org/10.1016/ S1474-4422(16)30157-0.
2015年度
- Hokari M, Yokoseki A, Arakawa M, Saji E, Yanagawa K, Yanagimura F, Toyoshima Y, Okamoto K, Ueki S, Hatase T, Ohashi R, Fukuchi T, Akazawa K, Yamada M, Kakita A, Takahashi H, Nishizawa M, Kawachi I. Clinicopathological features in anterior visual pathway in neuromyelitis optica. Annals of Neurology 2016;79(4):605-624. doi: 10.1002/ana.24608. PMID: 26836302.
- Izumi Kawachi, Masatoyo Nishizawa. Cortical gray matter lesions in multiple sclerosis. Brain Nerve 2015;67(4):497-504. doi: 10.11477/mf.1416200166.
- Yajima R, Utsumi K, Ishihara T, Kanazawa M, Okamoto K, Kawachi I, Nishizawa M. Varicella-zoster virus encephalitis localized to the bilateral medial temporal lobes. Neurol Neuroimmunol Neuroinflamm. 2015 May 7;2(4):e108. doi: 10.1212/NXI.0000000000000108. eCollection 2015.
- Kawachi I, Nishizawa M. Significance of gray matter brain lesions in multiple sclerosis and neuromyelitis optica. Neuropathology 2015;35(5):481-486. doi:10.1111/neup.12216.
- Yajima R, Toyoshima Y, Wada Y, Takahashi T, Arakawa H, Ito, Kobayashi D, Yamada M, Kawachi I, Narita I, Takahashi H, Nishizawa M. A fulminant case of granulomatosis with polyangiitis with meningeal and parenchymal involvement. Case Rep Neurol 2015;7:101-104. DOI: 10.1159/000381942
- Kuroha Y, Tada M, Kawachi I, Nishizawa M, Matsubara N, Koike R. Effect of sodium pyruvate on exercise intolerance and muscle weakness due to mitochondrial myopathy: a case report. Rinsho Shinkeigaku 2015;55(6):412-416. doi: 10.5692/clinicalneurol.cn-000652.
- Yamasaki R, Matsushita T, Fukazawa T, Yokoyama K, Fujihara K, Ogino M, Yokota T, Miyamoto K, Niino M, Nomura K, Tomioka R, Tanaka M, Kawachi I, Ohashi T, Kaida KI, Matsui M, Nakatsuji Y, Ochi H, Fukaura H, Kanda T, Nagaishi A, Togo K, Mizusawa H, Murai H, Kira JI. Efficacy of intravenous methylprednisolone pulse therapy in patients with multiple sclerosis and neuromyelitis optica. Mult Scler. 2015 Nov 12. pii: 1352458515617248. [Epub ahead of print]. PMID: 26564994. doi: 10.1177/1352458515617248.
- Katayama K, Misawa S, Sato Y, Sobue G, Yabe I, Watanabe O, Nishizawa M, Kusunoki S, Kikuchi S, Nakashima I, Ikeda S, Kohara N, Kanda T, Kira J, Hanaoka H, Kuwabara S; J-POST Trial study investigators (Aoyagi R, Tanemura N, Inamata C, Sekiguchi Y, Shibuya K, Mitsuma S, Watanabe K, Iwai Y, Kawagashira Y, Koike H, Shirai S, Sasaki H, Futagawa T, Ushinohama K, Kawachi I, Mitsui Y, Kato M, Suzuki H, Niino M, Fujihara K, Tateyama M, Katoh N, Kawamoto M, Koga M, Matsuse D, Yamasaki R). Japanese POEMS syndrome with Thalidomide (J-POST) Trial: study protocol for a phase II/III multicentre, randomised, double-blind, placebo-controlled trial. BMJ Open. 2015 Jan 8;5(1):e007330. doi: 10.1136/bmjopen-2014-007330.
- Ogino M, Kawachi I, Otake K, Ohta H, Otsuka Y, Iwasaki K, Hiroi S. Current treatment status and medical cost for multiple sclerosis based on analysis of a Japanese claims database. Clinical and experimental neuroimmunology 2016 Article first published online: 23 MAR 2016. doi: 10.1111/cen3.12299.
2014年度
- Kawachi I. Deep grey matter involvement in multiple sclerosis: key player or bystander? J Neurol Neurosurg Psychiatry 2014;85(12):1293.doi:10.1136/jnnp-2014-308221.
- Kitahara M, Kanazawa M, Hatakeyama M, Yanagimura F, Sakagami T, Kawachi I, Nishizawa M. [A patient with granulomatosis with polyangiitis (Wegener’s granulomatosis) presenting with diplopia and blepharoptosis: a case report]. Brain Nerve. 2014 Jul;66(7):880-1.
- Akaza M, Tanaka K, Tanaka M, Sekiguchi T, Misawa T, Nishina K, Kawachi I, Nishizawa M, Mizusawa H, Yokota T. Can Anti-AQP4 Antibody Damage the Blood-Brain Barrier? European Neurology 2014;72(5-6):273-277. doi: 10.1159/000360619. Epub 2014 Oct 14.
- Izumi Kawachi, Etsuji Saji, Masatoyo Nishizawa. Gray matter lesions and cognitive impairment in multiple sclerosis. Rinsho Shinkeigaku 2014;54(12),1060-1062. doi: 10.5692/clinicalneurol.54.1060.
2013年度
- Yokoseki A, Saji E, Arakawa M, Kosaka T, Hokari M, Toyoshima Y, Okamoto K, Takeda S, Sanpei K, Kikuchi H, Hirohata S, Akazawa K, Kakita A, Takahashi H, Nishizawa M, and Kawachi I. Hypertrophic pachymeningitis: significance of myeloperoxidase anti-neutrophil cytoplasmic antibody. Brain 2014;137(2):520-536. DOI:10.1093/brain/awt314.
- Kawachi I, Kondo T. T lymphocytes: Helpers. ENCYCLOPEDIA OF LIFE SCIENCES 2013; Published online: September 2013. DOI: 10.1002/9780470015902.a0001224.pub3.
- Titulaer MJ, McCracken L, Gabilondo I, Iizuka T, Kawachi I, Bataller L, Torrents A, Rosenfeld MR, Balice-Gordon R, Graus F, Dalmau J. Late-onset anti-NMDA receptor encephalitis.Neurology 2013; 81(12):1058-1063. DOI: 10.1212/WNL.0b013e3182a4a49c.
- Kira J, Yamasaki R, Yoshimura S, Fukazawa T, Yokoyama K, Fujihara K, Ogino M, Yokota T, Miyamoto K, Niino M, Nomura K, Tomita R, Tanaka M, Kawachi I, Ohashi T, Kaida K, Matsui M, Nakatsuji Y, Ochi H, Kanda T, Nagaishi A, Togo K, Mizusawa H, Kawano Y. Efficacy of methylprednisolone pulse therapy for acute relapse in Japanese patients with multiple sclerosis and neuromyelitis optica: a multicenter retrospective analysis: 1. Whole group analysis. Clinical and Experimental Neuroimmunology 2013:4(3):305-317. DOI: 10.1111/cen3.12071.
- Niino M, Mifune N, Kohriyama T, Mori M, Ohashi T, Kawachi I, Shimizu Y, Fukaura H, Nakashima I, Kusunoki S, Miyamoto K, Yoshida K, Kanda T, Nomura K, Yamamura T, Yoshii F, Kira J, Nakane S, Yokoyama K, Matsui M, Miyazaki Y, Kikuchi S. Apathy/depression, but not subjective fatigue, is related with cognitive dysfunction in patients with multiple sclerosis. BMC Neurology 2014:14(1):3. doi: 10.1186/1471-2377-14-3.
- Kawachi I, Nishizawa M. Gray matter involvement in multiple sclerosis and neuromyelitis optica. Clinical and Experimental Neuroimmunology 2014;5(1):69-76. DOI: 10.1111/cen3.12077.
2012年度
- Saji E, Arakawa M, Yanagawa K, Toyoshima Y, Yokoseki A, Okamoto K, Otsuki M, Akazawa K, Kakita A, Takahashi H, Nishizawa M, Kawachi I. Cognitive impairment and cortical degeneration in neuromyelitis optica. Annals of Neurology 2013;73(1):65-76.DOI: 10.1002/ana.23721.
- Maarten J Titulaer, Lindsey McCracken, Iñigo Gabilondo, Thaís Armangué, Carol Glaser, Takahiro Iizuka, Lawrence S Honig, Susanne M Benseler, Izumi Kawachi, Eugenia Martinez-Hernandez, Esther Aguilar, Núria Gresa-Arribas, Nicole Ryan-Florance, Abiguei Torrents, Albert Saiz, Myrna R Rosenfeld, Rita Balice-Gordon, Francesc Graus, Josep Dalmau. Treatment and prognostic factors for long-term outcome in patients with anti-NMDA receptor encephalitis: an observational cohort study. Lancet Neurology 2013;12(2):157-65. doi: 10.1016/S1474-4422(12)70310-1. Published online January 3, 2013.
- Takado Y, Shimohata T, Kawachi I, Tanaka K, Nishizawa M. Successful treatment of neuroborreliosis with combined administration of antibiotics and steroids: A case report. Rinsho Shinkeigaku 2012;52(6):411-5. http://dx.doi.org/10.5692/clinicalneurol.52.411.
- Hironishi M, Ishimoto S, Sawanishi T, Miwa H, Kawachi I, Kondo T. Neuromyelitis optica following thymectomy with severe spinal cord atrophy after frequent relapses for 30 years. Brain Nerve 2012;64(8):951-5.
- Uemura M, Kosaka T, Shimohata T, Ishikawa M, Nishihira Y, Toyoshima Y, Yanagawa K, Kawachi I, Takahashi H, Nishizawa M. Dropped head syndrome in amyotrophic lateral sclerosis. Amyotroph Lateral Scler Frontotemporal Degener.2013;14:232-3.doi: 10.3109/17482968.2012.727424.
- Kawachi I, Yanagawa K, Saji E, Yokoseki A, Hokari M, Nishizawa M. Diagnostic dilemma of Japanese patients with AQP4 antibody. Multiple Sclerosis Journal 2012;18(S4):71.
- Yokoseki A, Saji E, Arakawa M, Hokari M, Ishiguro T, Yanagimura F, Ishihara T, Okamoto K, Nishizawa M, Kawachi I. Relapse of multiple sclerosis in a patient retaining CCR7-expressing T cells in CSF under fingolimod therapy. Multiple Sclerosis Journal 2013;19(9):1230-1233.doi: 10.1177/1352458513481395.
2011年度
- Kitamura A, Maekawa Y, Uehara H, Izumi K, Kawachi I, Nishizawa M, Toyoshima Y, Takahashi H, Standley DM, Tanaka K, Hamazaki J, Murata S, Obara K, Toyoshima I, Yasutomo K: A mutation in the immunoproteasome subunit PSMB8 causes autoinflammation and lipodystrophy in humans. J Clin Invest 2011, 121:4150-60.
- Katsumata Y, Kawachi I, Kawaguchi Y, Gono T, Ichida H, Hara M, Yamanaka H. Semiquantitative measurement of aquaporin-4 antibodies as a possible surrogate marker of neuromyelitis optica spectrum disorders with systemic autoimmune diseases. Mod Rheumatol. 2012;22(5):676-84.
- Kawachi I. Humoral and cellular immune responses in neuromyelitis optica. Rinsho Shinkeigaku. 2010;50:873-4.
- Ariizumi Y, Ozawa T, Tokutake T, Kawachi I, Hirose M, Katada S, Igarashi S, Tanaka K, Nishizawa M. Chorea as the first sign in a patient with elderly-onset systemic lupus erythematosus. Case reports in neurological medicine. 2012;2012:317082. Doi:10.1155/2012/317082.
- Konno T, Umeda Y, Umeda M, Kawachi I, Oyake M, Fujita N. A case of inflammatory myopathy with widely skin rash following use of supplements containing Spirulina. Rinsho Shinkeigaku. 2011;51:330-3.
2010年度
- Saji E, Kawachi I, Nishizawa M. Diagnosis and management of paraneoplastic neurological syndromes. Brain Nerve 2010;62:319-330.
- Kawachi I, Nishizawa M. Pachymeningitis. Nihon Naika Gakkai Zasshi 2010;99:1821-9.
- Kawachi I, Saji E, Toyoshima Y, Dalmau J, Nishizawa M. Treatment-responsive opsoclonus-ataxia associated with ovarian teratoma. J Neurol Neurosurg Psychiatry 2010;81:581-2.
- Tanaka Y, Kimura K, Kawachi I, Inuzuka T. No relapse of neuromyelitis optica during drug-induced B-lymophopenia with hypogammaglobulinemia. Neurology 2010; 75:1745-1747.
2009年度
- Yanagawa K, Kawachi I, Toyoshima Y, Yokoseki A, Arakawa M, Hasegawa A, Ito T, Kojima N, Koike R, Tanaka K, Kosaka T, Tan CF, Kakita A, Okamoto K, Tsujita M, Sakimura K, Takahashi H, Nishizawa M. Pathological and immunological profiles of a limited form of neuromyelitis optica with myelitis. Neurology 2009;73:1628-37.
